核酸分子雜交的類型
隨著基因工程研究技術的迅猛發展,新的核酸分子雜交類型和方法在不斷涌現和完善。核酸分子雜交可按作用環境大致分為固相雜交和液相雜交兩種類型。固相雜交是將參加反應的一條核酸鏈先固定在固體支持物上,一條反應核酸游離在溶液中。固體支持物有硝酸纖維素濾膜、尼龍膜、乳膠顆粒、磁珠和微孔板等。液相雜交所參加反應的兩條核酸鏈都游離在溶液中。
由于固相雜交后,未雜交的游離片段可容易地漂洗除去,膜上留下的雜交物容易檢測和能防止靶DNA自我復性等優點,故該法為常用。常用的固相雜交類型有:菌落原位雜交、斑點雜交、狹縫雜交、Southern印跡雜交、Northern印跡雜交、組織原位雜交和夾心雜交等。
液相雜交是一種研究早且操作復合的雜交類型,在過去的30年里雖有時被應用,但總不如固相雜交那樣普遍。其主要原因是雜交后過量的未雜交探針在溶液中除去較為困難和誤差較高。近幾年由于雜交檢測技術的不斷改進,商業性基因探針診斷盒的實際應用,推動了液相雜交技術的迅速發展。下面對固相雜交和液相雜交分別進行介紹。
(一)固相膜核酸分子雜交方法
固相核酸雜交多是在膜上進行,因此,以下主要介紹固相膜的核酸分子雜交方法:
1.DNA的變性
DNA變性解鏈是雜交成功的關鍵。Southern印跡雜交時DNA在凝膠中變性,變性方法是將凝膠浸在數倍體積的1.5mol/l NaCl和0.5mol/l NaOH中1h然后用數倍體積的1mol/l Tris –HCl(Ph8.0)和1.5mol/l NaCl溶液中和1h。DNA受酸、堿、熱等處理均能發生變性,但強酸會使核酸降解。一般認為堿變性較好,可避免DNA降解。熱變性在要低DNA濃度(100μg/ml)和低鹽濃度(0.1mol/l SSC 含15mmol/l NaCl - 1.5mmol/L檸檬酸三鈉,pH7.0)下進行。用SSC稀釋DNA溶液為50μg/ml,加10mol/l NaOH使終濃度為0.1mol/L(pH約12.8),室溫變性10min,很快置冰鹽水中,用10min/l HCl或5mol/l NaH2PO4調pH到7~8[亦可用堿變性后,調至中性,再加熱100。c 10min],DNA變懷可用OD260增加(約30%~40%)來檢測,變性DNA醇沉淀呈雪樣,完全失去纖維狀沉淀。變性后加入等量冷的12×SSC,冰浴保存。
2.變性DNA在硝酸纖維素膜上的固定
硝酸纖維素濾膜(孔徑0.45μm)先在蒸餾水中充分浸泡,再用6×SSC浸泡30min~2h,涼干。DNA樣品轉移或加至硝酸纖維素膜上后,先室溫干燥4h,然后在80度真空干燥2h或者在254nm紫外交聯儀用120mj能量固膜。
3.預雜交
濕潤的濾膜放入可加熱封口的塑料袋中,按每平方厘米濾膜加0.2ml預熱至60。C的預雜交液(6×SSC,0.5%,SDS,5×Denhardt液,100μg/ml鮭魚精DNA)。鮭魚精DNA需經過剪切和DNA酶消化處理,然后酒精沉淀純化,調濃度至10mg/ml,用前放100。C水浴中煮沸變性10min,冰水驟冷。盡可能將袋中氣泡趕盡,可封口器將袋口封住。將雜交袋浸入68度水浴保溫3~12h。當預雜交液溫度升至68度時,在濾膜表面常會形成小氣泡。輕輕晃動袋中液體即可除去這些小氣泡,這一點對于保證濾膜表面充分浸潤預雜交液很重要。
4.雜交
從水浴中取出塑料袋,用剪刀剪開一角,盡可能擠凈預雜交液。用吸管或大槍頭將雜交液加入袋中,用恰好是足量的液體保持濾膜濕潤(50μl/cm2)。溶液的組成是6×SSC,0.01mol/l EDTA, 變性的標記核酸探針,5×Denhardt液,0.5%SDS, 100μg/ml變性的鮭魚精DNA。盡可能趕盡氣泡后,將塑料袋嚴密封口,在分子雜交儀內進行雜交反應在68℃水浴中進行,所需時間視探針和檢測靶DNA的性質及探針的比活性等情況而定,一般4~20h。
5.洗膜
取出塑料袋,用剪刀剪開,小心取出濾膜,立即浸入盛有2×SSC和0.5%SDS溶液的盤中,室溫下漂洗5min。再將濾膜移入2×SSC和0.1%SDS溶液中,室溫下洗滌15min(輕輕搖動)。然后將濾膜移入0.1×SSC和0.5%SDS溶液中;68℃輕輕搖動保溫2h,更換緩沖液后繼續保溫30min。
洗膜的溫度一般應控制在低于Tm值12℃以上。(Tm = 69.3 + 0.41x(G +C) %)。雙鏈DNA的Tm值隨錯配堿基對數每增加1%而遞減1℃。
6.結果顯示 非放射性檢測方法前已述及,此處主要介紹放射性測定方法。固相膜的放射性雜交結果顯示有兩種方式,一是放射性自顯影法,另一種是液閃計數法。前一種方法比較簡單,只需將雜交膜與X光片在暗盒中曝光數小時至數天,再顯影、定影即可。對于雜交信號較弱的固相膜,用一塊增感屏可顯著增強曝光強度。此外,為了減弱32P的散射,曝光通常在-20℃或-80℃下進行。液閃計數法主要用于打點和狹縫雜交及為了比較兩個雜交信號的強弱等情形。方法是將完成雜交的膜在漂洗結束后剪成小塊(每份樣品1塊),80℃真空干燥后裝閃爍瓶。加入2~5ml閃爍液,剪2~3塊無樣品膜塊作為本底對照。在液體閃爍計數器上自動計數。液體計數測定放射性強度也可在放射自顯影之后進行。
(二)固相核酸分子雜交類型
1.菌落原位雜交(Colony in situ hybridization)
菌落原位雜交是將細菌從培養平板轉移到硝酸纖維素濾膜上,然后將濾膜上的菌落裂菌以釋出DNA。將NDA烘干固定于膜上與32P標記的探針雜交,放射自顯影檢測菌落雜交信號,并與平板上的菌落對位。
實驗步驟如下:
①將硝酸纖維素濾膜置于含抗生素的平皿瓊脂培養基上,用無菌牙簽挑取單菌落種于濾膜和主瓊脂平板上,排列成方格柵,膜和板上菌落位置相同。
②培養細菌至產生1~2mm大小的菌落。
③在一塊平皿中置4張濾紙,用10%SDS浸透,倒掉多余液體。將帶有菌落的濾膜取下,輕輕置于濾紙上,菌落面上在,注意防止在濾膜底面存有氣泡。
④5min后,將濾膜轉至用變性溶液(0.5mol/l NaCl , 0.5mol/L Tris·NaCl)浸濕的濾紙上,放置10min。
⑤將濾膜轉至中和溶液(1.5mol/l NaCl , 0.5mol/L Tris·HCl ,pH8.0)浸濕的濾紙上,放置10min。重復中和1次。
⑥將濾膜移至用2×SSPE溶液浸過的濾紙上,放置10min。SSPE配成20×貯備液:3.6mol/l NaCl, 0.2mol/L NaH2PO4(PH7.4), 20mmol/L EDTA(pH7.4)。
⑦將濾膜用濾紙吸干,80℃真空烘干2h。
以下操作參考前述。
2.斑點雜交(Dot blot)
斑點雜交法是將被檢標本點到膜上,烘烤固定或用紫外交聯儀輻照固定。這種方法耗時短,可做半定量分析,一張膜上可同時檢測多個樣品。為使點樣準確方便,市售有多種多管吸印儀(manifolds),如Minifold I和II、Bio-Dot (Bio –Rad )和Hybri –Dot,它們有許多孔,樣品加到孔中,在負壓下就會流到膜上呈斑點狀或狹縫狀,反復沖洗進樣孔,取出膜烤干或254nm紫外交聯儀內紫外線照射以固定標本,這時的膜就可以進行雜交。
(1)DAN斑點雜交
①先將膜在水中浸濕,再放到15×SSC中。
②將DNA樣品溶于水或TE,煮沸5min,冰中速冷。
③用鉛筆在濾膜上標好位置,將DNA點樣于膜上。每個樣品一般點50μl(2~10μg DNA)。
④將膜烘干,密封保存備用。
(2)RNA斑點雜交:
RNA斑點雜交與上法類似,每個樣品至多加10μg總RNA(經酚/氯仿或異硫氰酸胍提取純化)。方法是將RNA溶于5μlDEPC水,加15μl甲醛/SSC緩沖液(10×SSC中含0.15mol/l 甲醛)使RNA變性。然后取5~8μl點樣于處理好的濾膜上,烘干。
培養細胞,標本處理技術可以簡化,不用提取和純化RNA。方法是用含0.5%Nonidet P40的低滲緩沖液對多種動物細胞作簡單處理,離心去掉細胞核和細胞碎片,就得到基本不帶DNA而富含RNA的細胞質提取物,這一粗RNA在高鹽下用甲醛變性,不需加工直接點到硝酸纖維素膜上。本法可以快速檢測大量標本,而只需極少量的細胞(5×104)或組織。
整個RNA實驗中,要防止激活內源性RNase,有許多種預防措施,有一種是在樣品中加入核糖核苷氧礬基復合物(RVC)。
(3)完整細胞斑點雜交:應用類似檢測細菌菌落的方法,可以對細胞培養物的特異序列進行快速檢測。將整個細胞點到膜上,經NaOH處理,使DNA暴露、變性和固定,再按常規方法進行雜交與檢測。有人曾用此法從105個培養細胞中檢測到少至5pg 的Epstein – Barr病毒DNA。完整細胞斑點印跡法可以用于篩選大量標本,因為它是使細胞直接在膜上溶解,所以DNA含量甚至比常用的提取法還高,又不影響與32P標記的探針雜交。但它不適于非放射性標記探針,因為DNA純度不夠,會產生高本底。
3.Southern印跡雜交(southern blot )
Southern blot 是研究DNA圖譜的基本技術,在遺傳診斷DNA圖譜分析及PCR產物分析等方面有重要價值。Southern印跡雜交基本方法是將DNA標本用限制性內切酶消化后,經瓊脂糖凝膠電泳分離各酶解片段,然后經堿變性,Tris緩沖液中和,高鹽下通過毛吸作用將DNA從凝膠中轉印至硝酸纖維素濾膜上,烘干固定后即可用于雜交。凝膠中DNA片段的相對位置在DNA片段轉移到濾膜的過程中繼續保持著。附著在濾膜上的DNA與32P標記的探針雜交,利用放射自顯影術確定探針互補的每條DNA帶的位置,從而可以確定在眾多酶解產物中含某一特定序列的DNA片段的位置和大小。
(1)瓊脂糖凝膠電泳:利用瓊脂糖凝膠電泳可以很容易地將DNA限制酶消化片段(0.3~25kb)分離開。分離大分子DNA片段(800~12000bp)用低濃度瓊脂糖(0.7%),分離小分子片段(500~1000bp)用高濃度瓊脂糖(1.0%),300~5000bp的片段則用1.3%的瓊脂糖凝膠,根據分離樣品量、分離速度和分辨率要求的不同,可選用不同規格的電泳槽。
電泳時,同時將標記物加到旁邊孔中,便于確定樣品DNA的分子量。20伏恒壓電泳過夜。電泳畢,將膠浸到含0.5μg/ml EB的TBE緩沖液中染色30min,也可將EB直接加到電泳緩沖液中或在配膠前加入膠中,在254nm短波透射燈下拍照,加橙黃色濾色鏡,使用高速一次成像膠片,光圈f4.5,曝光20~40s。
(2)硝酸纖維素濾膜吸印。
①將膠切成合適大小,切去右上角作為記號。
②將膠放進盛有變性緩沖液(1.5mol/l NaCl, 0.5mol/L NaOH)的盤中輕搖動15min。
③換到中和緩沖液(1mol/L Tris·HCl , pH8.0, 1.5mol/L NaCl)中輕搖動30min。
④裁一張硝酸纖維素膜,2~4張3MM濾紙和一些吸印紙(可用衛生紙),都與膠的大小相同(硝酸纖維素膜和吸印紙不能比膠大,否則易形成旁路),先將硝酸纖維素膜浸到水中,再放入10×SSC中,接觸膠和硝酸纖維素膜時都要戴橡膠手套操作。
⑤平盤上放一塊比膠大的平板(盛膠槽翻過來即可),上面鋪一張3MM濾紙,起燈芯作用,盤中加少量10×SSC緩沖液(2.5cm厚),不能沒過平板,使3MM濾紙充分飽和。
⑥將膠倒扣到3MM濾紙上。
⑦浸濕的硝酸纖維素鋪在膠上,對齊,鋪膜時從一邊逐漸放下,防止產生氣泡,有氣泡時,可用吸管趕出,不能讓膜與膠下的濾紙直接接觸。
⑧膜上放一張3MM濾紙,不能與膠接觸。
⑨上面加吸印紙及重物(500g左右)。
⑩通過濾紙的灶芯作用,平盤中的緩沖液就會通過膠上移,從而將DNA吸印到膜上,及時更換浸濕的吸印紙。在室溫下轉印過夜。
⑾去除上面的東西,用鑷了將膜取出,在6×SSC中洗一下(也可不洗)。
⑿自然干燥,80℃烤2h。
⒀這時的膜就可進行雜交,或室溫密封保存。
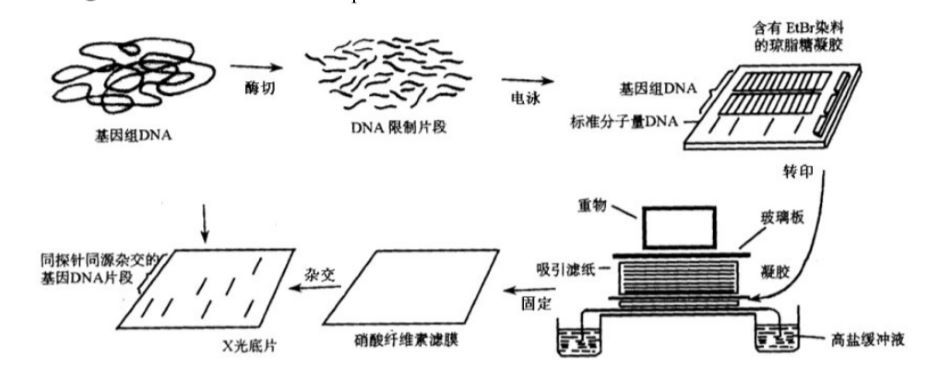
Southern印跡雜交技術
4.Northern印跡雜交(Northern blot)
這是一種將RNA從瓊脂糖凝膠中轉印到硝酸纖維素膜上的方法。DNA印跡技術由Southern于1975年創建,稱為Southern印跡技術。RNA印跡技術正好與DNA相對應,故被趣稱為Northern印跡雜交,與此原理相似的蛋白質印跡技術則被稱為western blot。Northern印跡雜交的RNA吸印與Southern印跡雜交的DNA吸印方法類似,只是在進樣前用甲基氧化汞、乙二醛或甲醛使RNA變性,而不用NaOH,因為它會水解RNA的2’-羥基基團。RNA變性后有利于在轉印過程中與硝酸纖維素膜結合,它同樣可在高鹽中進行轉印,但在烘烤前與膜結合得并不牢固,所以在轉印后不能用低鹽緩沖液洗膜,否則RNA會被洗脫。在膠中不能加EB,因它為影響RNA與硝酸纖維素膜的結合,為測定片段大小,可在同一塊膠上加標記物一同電泳,之后將標記物膠切下,上色、照像。樣品膠則進行Northern轉印,標記物膠上色的方法是在暗室中將其浸在含5μg/ml EB的0.1mol/L 醋酸銨中10min,在水中就可脫色。在紫外光下用一次成像相機拍照時,上色的RNA膠要盡可能少接觸紫外光,若接觸太多或白熾燈下暴露過久,會使RNA信號降低。從瓊脂糖凝膠中分離功能完整的mR-NA時,甲基氫氧化汞是一種強力、可逆變性劑,但是有毒,因而許多人喜用甲醛作為變性劑。操作均應避免RNase的污染。
下面介紹RNA甲醛凝膠電泳和吸印方法:
(1)試劑
10×MSE緩沖液:0.2mol/L 嗎啉代丙烷磺酸(MOPS),pH7.0, 50mmol/L 醋酸鈉,1mmol/l EDTA, pH8.0。
5×樣品緩沖液:50%甘油,1mmol/l EDTA, 0.4%溴酚藍。
甲醛:用水配成37%濃度(12.3mol/L)。應在通風柜中操作,pH高于4.0。
去離子甲酰胺。
50mmol/L NaOH(含10mmol/l NaCl)。
0.1mol/L Tris·HCl,Ph7.5。
(2)步驟
①40ml水中加7g瓊脂糖,煮沸溶解,冷卻到60℃,加7ml 10×MSE緩沖液、11.5ml甲醛,加水定容 至70ml,混勻后 倒入盛膠槽。
②等膠凝固后,去掉梳子和膠布,將盛膠槽放入1×MSE緩沖液的電泳槽。
③使RNA變性(多20μg):RNa 4.5μl,10×MSE緩沖液2.0μl,甲醛3.5μl,去離子甲酰胺10.0μl。
④55℃加熱15min,冰浴冷卻。
⑤加2μl 5×載樣緩沖液。
⑥上樣,同時加RNA標記物。
⑦60伏電泳過夜。
⑧取出凝膠,水中浸泡2次,每次5min。
⑨室溫下將膠浸到50mmol/L NaOH和10mmol/l NaCl中45min,水解高分子RNA,以增強轉印。
⑩室溫下將膠浸到0.1mol/L Tris·HCl (Ph7.5)中45min,使膠中和。
⑾20×SSC洗膠1h。
⑿20×SSC中過夜,轉印到硝酸纖維素膜上。
⒀取出硝酸纖維膜,80℃真空烘烤2h。
5.組織原位雜交(Tissue in situ hybridization)
組織原位雜交簡稱原位雜交,指組織或細胞的原位雜交,它與菌落的原位雜交不同。菌落原位雜交需裂解細菌釋出DNA,然后進行雜交。而原位雜交是經適當處理后,使細胞通透性增加,讓探針進入細胞內與DNA或RNA雜交。因此原位雜交可以確定探針的互補序列在胞內的空間位置,這一點具有重要的生物學和病理學意義。例如,對致密染色體DNA的原位雜交可用于顯示特定的序列的位置;對分裂期間核DNA的雜交可研究特定序列在染色質內的功能排布;與細胞RNA的雜交可分析任何一種RNA在細胞中和組織中的分布。此外,原位雜交還是顯示細胞亞群分布和動向及病原微生物存在方式和部位的一種重要技術。
用于原位雜交的探針可以是單鏈或雙鏈DNA,也可以是RNA探針。通常探針的長度以100~400nt為宜,過長則雜交效率減低。近研究結果表明,寡核苷酸探針(16~30nt)能自由出入細菌和組織細胞壁,雜交效率明顯高于長探針。因此,寡核苷酸探針和不對稱PCR標記的小DNA探針或體外轉錄標記的RNA探針是組織原位雜交的優選探針。
探針的標記物可以是放射性同位素,也可以是非放射性生物素和半抗原等。放射性同位素中,3H和35S為常用。3H標記的探針半衰期長,成像分辨率高,便于定位, 缺點是能量低。35S標記探針活性較高,影像分辨率也較好。而32P能量過高,致使產生的影像模糊,不利于確定雜交位點。
原位雜交中,標本的固定條件是影響雜交效率的重要因素,標本組織蛋白質的消化程度對探針進入細胞極為重要。去除蛋白的方法是,用0.2mol/l HCl處理載玻片,用蛋白酶K消化,然后用不同濃度的乙醇脫水,原位雜交還是一種新技術,發展很快,在敏感性、特異性和穩定性上還需要進一步完善和提高(詳見二十章 )。
6.固相夾心雜交
Dunn等早介紹了夾心雜交類型,Ranki等又作了進一步的改進。夾心雜交法比直接濾膜雜交法有兩個主要的優點:①樣品不需要固定,對粗制樣品能做出可靠的檢測;②用夾心雜交法比直接濾膜雜交法特異性強,因為只有兩個雜交物都雜交才能產生可檢測的信號。
固相夾心雜交需要兩個靠近而不互相重疊的探針,一個作固相吸附探針,另一個作標記檢測探針。樣品基因組內核酸只有使這兩個探針緊密相連才能形成夾心結構。需注意的是兩個探針必須分別亞克隆進入兩個分離的非同源載體內,以避免產生高的本底信號(如一個克隆人Puc19,另一克隆人pBR322)。
夾心雜交法可用濾膜和小珠固定吸附探針,使用小珠可更好地進行標準化試驗和更容易對小量樣品進行操作。Dahlen 等利用微孔板進行夾心雜交,可同時進行大量樣品檢測,他們先吸取DNA探針加到凹板中,然后用紫外線照射使其固定到塑料板上。用微孔板進行夾心雜交還可直接用于PCR技術。應用光敏生物標記探針檢測PCR產物的敏感性和用32P標記探針(3×108cpm/μg)作16h放射自顯影的Southern雜交的敏感性一樣。用微孔板雜交的其它優點還包括同時做多份樣品,加樣、漂洗和讀結果等步驟可以自動化。
7.其它雜交類型
(1)固化探針雜交:
該法較少使用,原理是使未標記固化探針通過雜交與靶RNA或DNA結合,漂洗后,用酶標抗DNA:RNA抗體或抗DNA:DNA抗體與雜交物結合。將乳膠顆粒收集,吸附到膜上后漂洗,加入底物顯色并進行測定。探針濃度2μg/ml,80℃雜交,可在10~15min完成,檢測的敏感性為5×108靶序列。
(2)反向雜交:這個雜交類型是用標記的樣品核酸與未標記的固化探針DNA雜交,故稱為“反向雜交”。這種雜交方法的優點是在一次雜交反應中,可同時檢測樣品中幾種核酸 。這種雜交方式主要用于進行中的核酸轉錄試驗和多種病原微生物的檢測。前者是在轉錄過程中標記RNA探針,后者可用光敏生物素制劑BPA標記樣品核酸。
(三)固相膜核酸雜交的幾點說明
1.雜交膜的選用
雜交膜是一種多孔、表面積很大的固相載體,核酸一旦固定在上面,就可用雜交法進行檢測。常使用的膜是硝酸纖維素膜,用于放射性和非放射笥標記探針都很方便,產生的本底淺,與核酸結合的化學性質不是很清楚,推測為非共價鍵結合。經80℃烤干2h或在紫外交聯儀輻照等雜交處理后,核酸仍不會脫落。硝酸纖維素膜的另一特點是只與蛋白有微弱非特異結合,這在使用非同位素探針中尤為有用。硝酸纖維素膜的缺點是結合核酸能力的大小取決于轉印條件和高濃度鹽(>10×SSC),與小片段核酸(<200bp)結合不牢,質地脆,不易操作。
尼龍膜在某些方面比硝酸纖維素膜好,它的強度大、耐用,可與小至10bp的片段共價結合。在低離子濃度緩沖液等多種條件下,它們都可與DNA單鏈或RNA緊密結合,且多數膜不需燒烤。尼龍膜韌性好,可反復處理與雜交,而不丟失被檢標本。它通過疏水鍵和離子鍵與核酸結合,結合力為350~500μg/cm2,比硝酸纖維素膜(80~100μg/cm2)強許多。尼龍膜的缺點是對蛋白有高親合力,不宜使用非同位素探針。
2.“噪音”的排除
“噪音”(noise)是固相膜雜交方法常遇到的問題,指標記DNA結合到空白膜上的放射性計數,即本底。這個問題的克服一是使用高純度的核酸制品和充分嚴格的雜交條件:二是選擇合適的雜交反應液和對膜進行處理。研究發現,隨著離子強度的增加,空白膜(未固定DNA對照膜)上的“噪音”水平增加,而在50%甲酚胺6×SSC的雜交反應液中充分封閉膜上的多余非特異結合位點。
(四)液相核酸分子雜交類型
1.吸附雜交
(1)HAP吸附雜交:羥基磷灰石(HAP)層析或吸附是液相雜交中早使用的方法。在液相中雜交后,DNA:DNA雜交雙鏈在低鹽條件可特異地吸附到HAP上。通過離心使吸附有核酸雙鏈的HAP沉淀,再用緩沖液離心漂洗幾次HAP,然后將HAP置于計數器上進行放射性計數。
(2)親合吸附雜交:生物素標記DNA探針與溶液中過量的靶RNA雜交,雜交物吸附到酰化親合素包被的固相支持物(如小球)上,用特異性抗DNA:RNA雜交物的酶標單克隆抗體與固相支持物上的雜交物反應,加入酶顯色底物,這個系統可快速(2h)檢測RNA。
上海峰志儀器有限公司銷售分子雜交實驗用的藍光透射儀、紫外交聯儀、分子雜交箱等實驗儀器,如想了解產品詳細技術參數和價格,請撥打電話網頁底部咨詢(也可直接.)。








 添加微信咨詢!
添加微信咨詢!