光化學反應的特點
作者:上海峰志儀器 時間:2020-07-26 20:49:26瀏覽9372 次
信息摘要:
光化學反應的途徑與產物往往和熱化學反應不同。只要光的波長適當,能為物質所吸收,即使在很低的溫度下,光化學反應仍然可以進行溫度對光化學的影響甚微,可以忽略不計。而熱化學反應對溫度十分敏感。光化學反應與熱化學反應動力學也不相同。反應物分子話化是通過吸收光量子而實現的。光化學反應的速率及平衡組成與吸收光強度(Ia)有關,有時與反應物濃度無關。
我們說光化學是研究光與物質相互作用的科學,如果在光的作用下,物質發生了化學反應我們稱為光化學反應。光化學反應與一股熱化學反應相比有許多不同之處,主要表現在,加熱使分子活化時,體系中分子能量的分布服從玻爾茲曼分布:面分子受到光激活時,原則上可以做到選擇性激發,體系中分子能量的分布屬于非平衡分布。所以光化學反應的途徑與產物往往和基態熱化學反應不同,只要光的波長適當,能為物質所吸收,即使在很低的溫度F,光化學反應仍然可以進行。
光化學反應系統中光化學過程可分為初級過程和次級過程。初級過程是分子吸收光子使電子激發,分子由基態提升到激發態,激發態分子的壽命一服較短。 光化學主要與低激發態有關,激發態分子可能發生解離或與相鄰的分子反應,也可能過渡到一個新的激發態上去,這些都屬于初級過程,其后發生的任何過程均稱為次級過程。分子中的電子狀態、振動與轉動狀態都是量子化的,即相鄰狀態間的能量變化是不連續的。因此分子敝發時的初始狀態與終止狀態不同時,所要求的光子能量也是不同的,而且要求二者的能量值盡可能匹配。
由于分子在一股條件下處于能量較低的穩定狀態,稱為基態。受到光照射后,如果分子能夠吸收電磁輻射,就可以提升到能量較高的狀態,稱為激發態。如果分子可以吸收不同波長的電磁輻射,就可以達到不同的激發態。按其能量的高低,從基態往上依次稱為激發態、第二激發態等,光化學研究中,把高于激發態的激發態統稱為高激發態。
激發態分子的壽命般較短,而且激發態能級越高,其壽命越短,以致來不及發生化學反應,所以光化學主要與低激發態有關。激發時分子所吸收的電磁輻射能有兩條主要的耗散途徑:一是和光化學反應的熱效應合并:二是通過光物理過程轉變成其他形式的能量。
光物理過程可分為輻射弛豫過程和非輻射弛豫過程。輻射弛豫過程是指將全部或部分多余的能量以輻射能的形式耗散掉,分子回到基態的過程,如發射熒光或磷光:非輻射弛豫過程是指多余的能量全部以熱的形式耗散掉,分子回到基態的過程。
決定一個光化學反應的真正途 徑往往需要建立若干個對應于不同機理的假想模型,找出各模型體系與濃度、光強及其他有關參量間的動力學方程,然后考察哪個模型與實驗結果的相符合程度zui高,以決定哪一個是zui可能的反應途徑。
光化學反應機理的研究中常用實驗方法很多。 研究中一股需要結合各種穩態,瞬態的光譜儀器,分析光化學研究反應過程的中間體,如采用同位素示蹤原子標記法等方法可以更方便地確定反應歷程。在光化學中zui早采用的熒光猝滅法仍是一種簡單有效的方法。 這種方法是通過被激發分子所發熒光,被其他分子猝天的動力學測定來研究光化學反應機理的。由于吸收什么波長的光往往是由分子中某個基團的性質決定的,所以光化學可以使分子中某特定位置直接發生化學反應,對于那些缺乏選擇性熱化學反應或者反應發生后的體系被破壞的熱化學反應更為可貴。光化學反應的另特點是 用光子作為反應試劑,-且被反應物吸收后,不會在體系中留下其他新的雜質,因而可以看成是“zui純”的試劑。所以和熱化學方法相比,光化學合成方法具有反應速率快、產物單一和副產物少等優點。
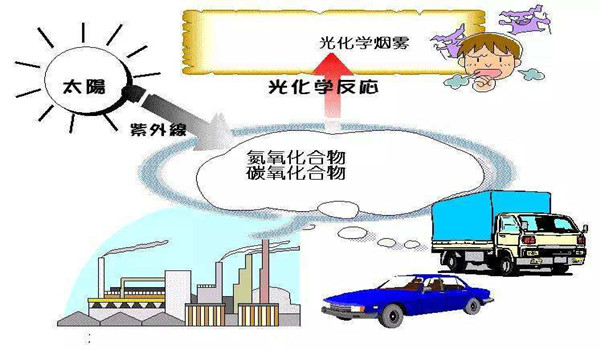
光化學反應是自然界 十分重要的現象,可以說有光的地方就有光化學反應的發生。地球與行星的大氣現象,如大氣構成、極光、輻射屏蔽和氣候等,均和大氣的化學組成與對它的輻照情況有關。處于高空處大氣的原子與分子吸收太陽輻射后會發生光化學反應。導致它和在地表上我們熟知的主要由氮氣與氧氣組成的空氣完全不同。
解了光化學以后,另一個和光化學休威相關的名詞是光物理。了解具體的光化學過程必須要熟悉激發態的物理性質。
所以說它們二者之間互相沙透,互相補充,特別是近30年來,由于激光的間世,光學的面貌發生了深刻的變化,光物理的研究內容也從傳統的光學與光譜學迅速擴展到光學與物理其他分支學科的交匯點。
諸如激光物理、非線性光學、高分辦率光諾學、強光光學和量子光學正不斷趨于完善和成熟,有的則正在積累形成新的分支學科,如光子學、超快光譜學和原子光學等,光物理與化學、生物學、醫學及生命科學的交叉也越來越廣泛和深人。光物理學中的新理論、新概念和新方法已成為激光、光纖通信等高技術產業發展的重要依托。
光化學有兩條基本定律,光化學定律是在1818年由Grothuss和Draper提出:只有被系統吸收的光才可能產生光化學反應。不被吸收的光(透過的光和反射的光)則不能引起光化學反應。只有為反應所吸收的輻射光,才能有效地產生光化學變化。光化學第二定律是在1908 ~ 1912年由Esinstein 和Stark提出:在初級過程中,一個光量子活化個分子。
光化學反應與一 般熱化學反應相比有許多不同之處,主要表現在:熱化學反應中,加熱使分子活化時,體系中分子能量的分布服從玻爾數曼分布。
面光化學反應中,分子受到光徽活時,原則上可以做到選擇性激發(包括能量躍遷值的選擇,電子激發態模式的選擇等),體系中分子能量的分布屬于非平衡分布。
所以光化學反應的途徑與產物往往和熱化學反應不同。只要光的波長適當,能為物質所吸收,即使在很低的溫度下,光化學反應仍然可以進行溫度對光化學的影響甚微,可以忽略不計。而熱化學反應對溫度十分敏感。
光化學反應與熱化學反應動力學也不相同。反應物分子話化是通過吸收光量子而實現的。光化學反應的速率及平衡組成與吸收光強度(Ia)有關,有時與反應物濃度無關。
溫度對光化學反應兒乎設影響。熱反應的吉布斯自由能△G<0,而光化學反應的吉布斯自由能可能△G>0.熱化學反應的速率常數比較大,面光化學反應的速率常數很小,有的時候近似于0.
光化學反應速率的平衡
光化學反應跟熱化學反應不同,光化學反應是-個緩慢的過程。從本質上說光化學反應是一個對峙反應。在反應發生的正反兩個方向,只要有一個方向是光化學反應,則其平衡即稱為光化學平衡。井且光化學平衡的濃度與反應物吸收光的強度成正比。下式為一個簡單分子A的光聚合反應。A可以在光照的作用下聚合生成聚合體A2,生成的A2也可以分解為A2的濃度正比于光照的強度。
hv
2A?A2
[A2]∝Ia
在光化學反應速率中反應速率常數正比于光強度,也就是說跟吸收光的強度有關。即: r=kIa其中,Ia為吸收光速率。在光化反應動力學中,用下式定義光化學反應量子產率更合適:
r
∮=一
Ia
式中,r為反應速率,用實驗測量: I,為吸收光速率,用露光計測量。
光敏反應
有些物質對光不敏感,不能直接吸收某種波長的光而進行光化學反應。如果在反應體系中加人另外一種物質,它能吸收這樣的輻射,然后將光能傳遞給反應物,使反應物發生作用,而該物質本身在反應前后并未發生變化,這種物質就稱為光敏劑,又稱感光劑。光敏反應就是由光敏劑引發的反應。它的概念有點類似我們熟悉的催化劑。
例如:
H2+hv→2H
這個反應可以用Hg為光敏劑。
CO2=H2O→02 +(C6H12O6)n
這是我們熟悉的光合作用,反應中葉綠素為光敏劑。
光化學的量子效率、量子產率和能量轉化效率
為了衡量一個光量子引致指定物理或化學過程的效率,在光化學中定義了量子效率。量子效率可以定義為生成產物的分子數與吸收的光子數的比值,也可以定義為生成產物的物質的量與吸收光子的物質的量的比值。可以表示如下:
生成產物的分子數 生成產物的物質的量
∮=一一一一一一一一一=一一一一一一一一一一
吸收的光子數 吸收光子的物質的量
量子效率∮是光化學反應中一個很重要的物理量,可以說它是研究光化學反應機理的敲門磚,可為光化學反應動力學提供許多信息。當∮>1,是由于初級過程活化了一個分子,而次級過程中又使若干反應物發生反應。如: H2+C2I→2HCI 的反應,1個光子引發了一個鏈反應,量子效率可達106次方。當∮<1,是由于初級過程被光子活化的分子尚未來得及反應,便發生了分子內或分子間的傳能過程而失去活性.
(2)量子產率(quantum yield)
發生反應的分子數 發生反應的物質的量
∮=一一一一一一一一一=一一一一一一一一一一
吸收的光子數 吸收光的物質的量
由于受化學反應式中計量系數的影響,量子效率與量子產率的值有可能不等,例如,下列反應的量子效率為2,量子產率卻為1.一般也用符號∮表示,也有很多書并不區分量子效率和量子產率。
2HBr+hv→H2+Br2
(3)能量轉化效率
對一定波長的單色光進行的光化學反應,能量轉化效率可以表示如下:
△rGm∮
η=一一一一
Ev
式中,△rGm為激發態的吉布斯自由能:∮為將光子轉化為化學產物的量子產率,Ev為人射光的總輻照度,W/m2。
值得注意的是光化學反應的量子效率可以小于 1,也可以大于1,但無論量子效率是小于1,還是大于1.其能量轉化效率都不能超過1。
生活中的光化學現象
人類開始系統地進行光化學研究已有近百年的歷史,然而光化學形成化學的一個新興分支學科則還不是半個世紀。光化學學科在20世紀60年代形成后,其發展十分迅速。在光化學形成化學的一個獨立分支學科之前,高等學校的光化學課程一直歸屬于物理化學中動力學的教學內容。
20世紀60年代激光的發現和70年代初發生的石油危機,大大促進了化學和物理交叉學科的發展。現代光化學或稱激發態化學的研究,早已不僅局限于化學和物理領城的交叉,它正在向材料科學、生命科學、環境科學、能源科學,甚至信息科學等諸多技術領域滲透,形成諸如生物光化學、環境光化學、光電化學、超分子光化學、光催化和光功能材料等新的分支和邊緣學科。
因此可以說,光化學現在已經是化學與材料科學、能源科學、生命科學、環境科學等諸多科技領城相關的一門基礎學科。按照普遍的定義,光化學是研究物質(原子、小分子)因受光的影響而產生性化學效應的一個學科。
由于歷史的和實驗技術方面的原因,光化學所沙及的光的波長范圍為100~ 1000nm,即由紫外至近紅外波段。比紫外波長更短的電磁輻射,如X或y射線所引起的光電離和有關化學變化,則屬于輻射化學的范疇。至于遠紅外或波長更長的電磁波,L般認為其光子能量不足以引起光化學過程,因此不屬于光化學的研究范疇。近年來觀察到有些化學反應可以由高功率的紅外激光所引發,將其歸屬于紅外激光化學的范疇。
人們對日常生活中的光化學現象早就觀察到了。例如,染過色的衣服經光的照射會褪色.這是因為染色衣物經多次水洗和長期日曬,使衣物上的染料發生光分解和光氧化,從而使衣物出現了褪色現象。這種現象不是一蹴而就,而是逐步發生的,其過程是比較復雜的。這正是光化學反應的特點。當陽光照射在染色衣物上時,光能激發了染料分子使之活化。活化的染料分子更容易與其他物質發生反應,例如跟空氣中的氧反應,若有水分子的存在則會進一步加劇化學反應的程度。由于染料分子的氧化或還原反應,而使染色衣物發生褪色。如用偶氮染料染色的棉纖維織物經日曬褪色,是因為氧化作用的結果,而用同種染料染色的蛋白纖維織物經日曬褪色,卻是還原作用的結果。又如,變色鏡片是在普通玻璃中加入了適量的溴化銀和氧化銅的微小品粒。當強光照射時,溴化銀分解為銀和溴。分解出的銀的微小晶粒,使玻璃星現暗棕色。當光線變暗時,銀和溴在氧化銅的催化作用下,重新生成澳化銀,于是,鏡片的顏色又變淺。具體反應如下:
hv
2AgBr → 2Ag+Br2
CuO
2Ag+Br2 → 2AgBr
植物受到光照會生長 (光合成), 即我們常說的光合作用。光合作用是指綠色植物通過葉綠體,利用光能,把二氧化碳和水轉化成儲存著能量的有機物,并且釋放出氧的過程。我們每時每刻都在吸人光合作用釋放的氧,我們知道在地球上的生命是依靠太陽的能量生存著,而光合作用是唯-能捕獲此能量的重要生物途徑。所以,光化學過程是地球上zui普遍、zui重要的過程之一,不論是通過理論還是實驗技術的方法,與光合作用相關的光化學研究一直是一個極活躍的領城。
上海峰志儀器有限公司銷售多種波段的光化學反應器,有254nm、365nm、455nm、555nm、660nm等多種波段,還有led 16通道平行光光化學反應器。









 添加微信咨詢!
添加微信咨詢!